Estudio de la Adsorción de Ag(I) en sistemas acuosos con sílices amino y tiol modificadas con magnetita
Por: Lluvia Yasmín Navarro Romo1, Carmen Salazar-Hernández2*, Enrique Elorza Rodríguez1, Juan Manuel Mendoza-Miranda2, Mercedes Salazar Hernández1*.
Resumen
La recuperación del Au de las soluciones ricas de cianuración se realiza usualmente por adsorción en carbón activado, proceso que presenta como principal desventaja la formación de finos en las cribas clasificadoras, dichos finos representan una considerable pérdida de valores en el proceso, es por ello que la búsqueda de alternativas que permitan la recuperación del oro y la plata de las soluciones ricas de cianuración es de interés para la hidrometalurgia, en este sentido la pre-concentración magnética podría ser una alternativa para dicho proceso; el presente trabajo muestra el estudio de la remoción de AgNO3 y [Ag(CN)2]– en sistemas acuosos sintéticos con sílices mesoporosas amino y/o tiol modificadas con magnetita (MS-NH2-Fe3O4 y MS-NH2-SH-Fe3O4). Se observa que la presencia de ligandos de naturaleza más blanda favorece la remoción de la Ag en los sistemas Ag-CN, mostrando baja capacidad de remoción los materiales aminados.
Palabras Clave: Cinauración, Sílice, remoción Ag(I)
Abstract
The recovery of Au from rich cyanidation solutions is usually carried out by adsorption on activated carbon, a process that presents as its main disadvantage the formation of fines in the classifying screens, these fines represent a considerable loss of values in the process, which is why The search for alternatives that allow the recovery of gold and silver from rich cyanidation solutions is of interest to hydrometallurgy.
In this sense, magnetic pre-concentration could be an alternative for said process. the present work shows the study of the removal of AgNO3 and [Ag(CN)2]– in synthetic aqueous systems with mesoporous amino and/or thiol silicas modified with magnetite (MS-NH2-Fe3O4 and MS-NH2-SH-Fe3O4) . It is observed that the presence of ligands of a softer nature favors the removal of Ag in Ag-CN systems, showing low removal capacity for amine materials.
Key Word: Mesoporous Silica, Amino and tiol modification, Silver remove
Introducción
En los últimos años se han estudiado los nano-materiales híbridos magnéticos como adsorbentes en la recuperación de iones metálicos, estos se han propuesto como una alternativa en la hidrometalurgia para la recuperación de metales preciosos principalmente (Pd, Pt, Rh, Ag y Au) y tierras raras de procesos de recuperación de desechos electrónicos [1-10]. Estas propuestas implican el uso de un material nano-estructurado magnético como Fe3O4, γ-Fe2O3, CoFe2O4, MnFe2O4 entre otros; estos materiales suelen ser recubiertos con una película de un surfactante, polímero o silica como una película protectora y que favorezca la modificación de la superficie del magneto con diversos grupos funcionales que otorgan la selectividad al ion metálico de interés [1]. El principio de estos materiales es la adsorción del ion metálico con el grupo funcionalizante, que puede realizarse mediante una adsorción física o una inmovilización covalente [1-10].
Una de las ventajas que muestran los recubrimientos con sílice, es la facilidad del anclaje de una gran diversidad de grupos funcionales mediante la condensación de diversos alquil-arilsilanos. [1-10]. Recientemente se ha planteado el uso de sílices mesoporosas (MS) tipo SBA-15, modificada con magnetita y grupos quelantes N,N,O donadores para la recuperación de trazas de Cd(II), Ni(II), Pb(II) y Zn(II) en disoluciones acuosas [6-13].
Recientemente, se ha reportado el uso de compósitos de magnética con redes metálicas, polímeros y matrices mesoporosas de sílica, carbón activado y otros cerámicos, para la remoción de diversos contaminantes en medios acuosos y en suelo, como por ejemplo U(VI), Cd, Ni, Pb y diversos contaminantes orgánicos como aceites y colorantes [14-19]. El presente trabajo muestra el estudio de la remoción de Ag(I) de sistemas acuosos con materiales mesoporosos de sílice modificados con magnética y grupos amino y mercapto.
Sección experimental
Síntesis y Caracterización de la Fe3O4
La síntesis de la magnetita, se realizó mediante técnicas de precipitación de acuerdo a la ecuación 1, en una relación 2Fe3+:Fe2+ [20-22]. En un matraz de 250 mL son disueltos en 200 mL de agua 5.27 g de FeSO4 y 2.7 g de FeCl3 bajo agitación constante, posteriormente se ajusta el pH a 10-11 con NH4OH y el sistema es colocado a reflujo por 24h, al término de este tiempo, es recuperada la magnetita por filtración y secada a 75oC por 12 h.
2FeCl3 + FeSO4 + 8 NH4OH —-> Fe3O4 + (NH4)2SO4 + 6 NH4Cl + 4 H2O
Reacción 1
La magnetita, fue caracterizada por DRX en polvo, la cual se llevó a cabo en un difractómetro de rayos X modelo ULTIMA IV de RIGAKU.
Síntesis y Caracterización de MS-NH2-Fe3O4 y MS-NH2-SH-Fe 3O4
La síntesis de los materiales mesoporosos de sílice, se realizó a partir de silicato de sodio utilizando como tamiz molecular el P-123 de acuerdo a Salazar y col. [23].
La modificación con grupos amino y/o tiol en la sílice mesoporosa, se realizó mediante técnicas de pos-síntesis. Se suspendió 0.167 moles de la sílice mesoporosa en 100 mL de etanol y se adicionaron 0.0416 moles del agente modificante 3-aminopropiltrimetoxisilano y/o 3-mercaptopropiltrimetoxisilano, se adiciona 1 mL de NH4OH y el sistema se deja bajo reflujo por 24 h. Al término del tiempo el sólido es recuperado y lavado con 2 porciones de 10 mL de etanol y 10 mL de acetona, para posteriormente ser secado en la estufa por 12 h a 75 oC.
El anclaje de la magnetita en las sílices modificadas se realizó colocando bajo reflujo 1g de la Fe3O4 sintetizadas con 10 g de la MS-NH2 por 12 h, posteriormente, el material es recuperado por filtración y secado a 70 oC por 12 h.
Estudios de Adsorción de Ag(I) de sistemas acuosos
La evaluación de la capacidad de adsorción de plata (I) fue realizada determinando las cinéticas de adsorción en intervalos de 10 minutos por 1 hora con soluciones estándares de AgNO3 a diferentes concentraciones (100-500 ppm). Se colocaron 0.1 g del material con 10 mL de una solución a 57, 123,192, 319 y 694 mgL-1 de Ag y se determinó a los tiempos antes mencionados la concentración residual de plata en la disolución mediante espectrometría de absorción atómica.
La capacidad de adsorción de la plata fue determinada mediante la ecuación 1, en donde qt es la carga al tiempo t, Co y Ct, son las concentraciones de plata en la disolución iniciales y al tiempo t en mgL-1, V el volumen de muestra utilizada (L) y m la masa de material utilizado en g.
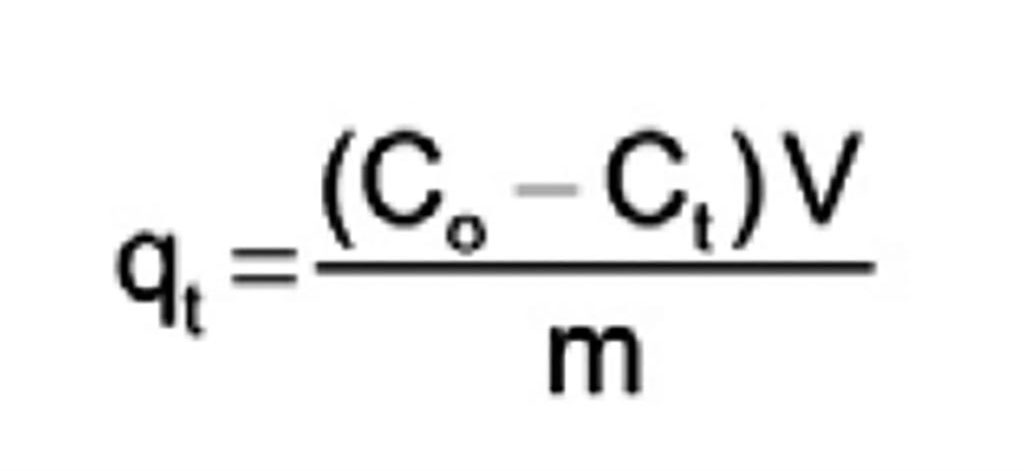
Ecuación 1
Efecto del pH en la Adsorción de Ag(I)
El Efecto del pH en la capacidad de adsorción de la magnetita, se evaluó determinando la capacidad de adsorción de la magnetita a pH de 3, 4.5, 6 y 10. Se colocaron 0.1 g del material con 10 mL de una solución de Ag(I) al pH en estudio por 20 minutos y se determinó la concentración de la Ag residual en la disolución.
Resultados y Discusión
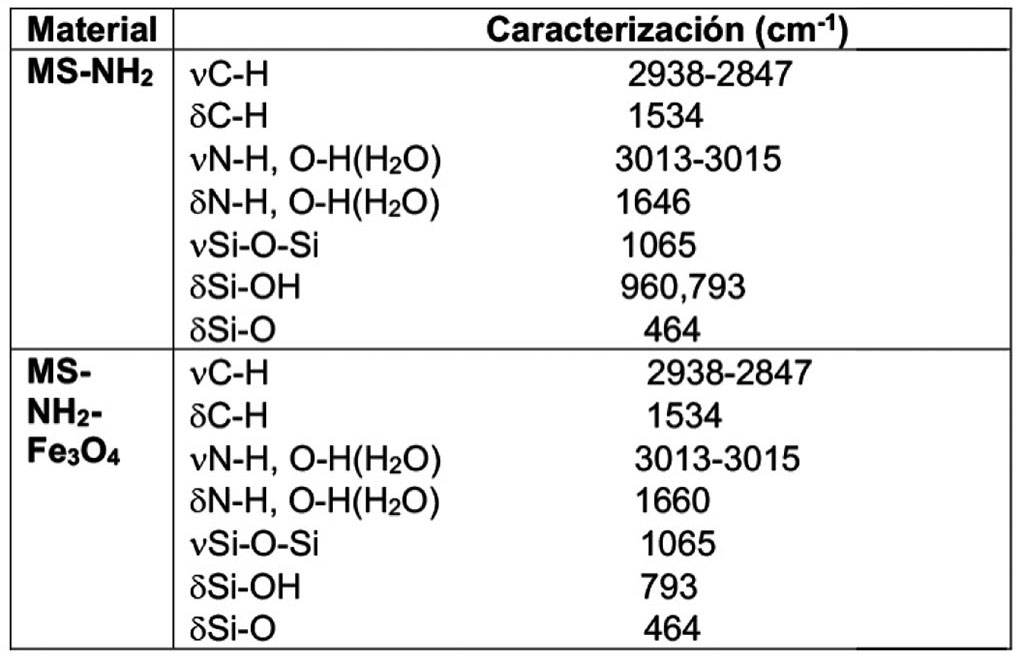
La caracterización por FTIR de las sílices modificadas con los diversos grupos amino, muestra la presencia de la materia orgánica en el rango de los 3000-2500 cm-1 y de 1600-1200cm-1, en la Tabla 1, resume la caracterización por FTIR de dichas muestras, en todos los casos se observa un desplazamiento de la vibración de δ C-N que sugiere la interacción N→Fe en los materiales, la asignación de las principales vibraciones en estos materiales es resumida en la Tabla 1.
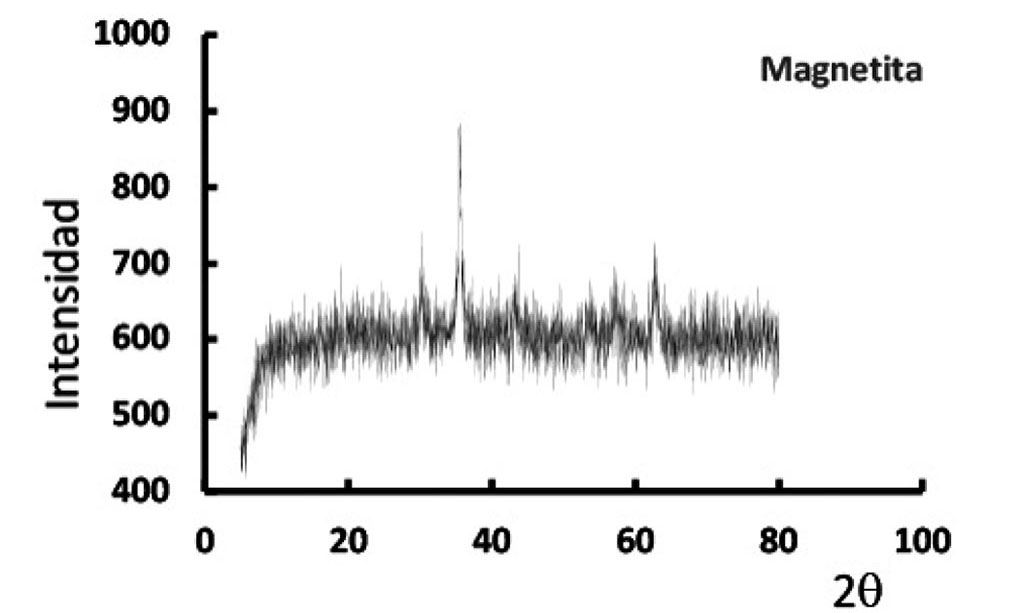
La Figura 1, muestra el difractograma de la magnetita sintetizada, corroborándose la obtención de dicha fase. Se observaron los planos a 2θ a 30.1, 35.4, 43.1, 54.5, 57.6, 62o, que corresponden a la magnetita de acuerdo a Mohammadi y col. [22].
Estudios de Adsorción de AgNO3 de sistemas acuosos
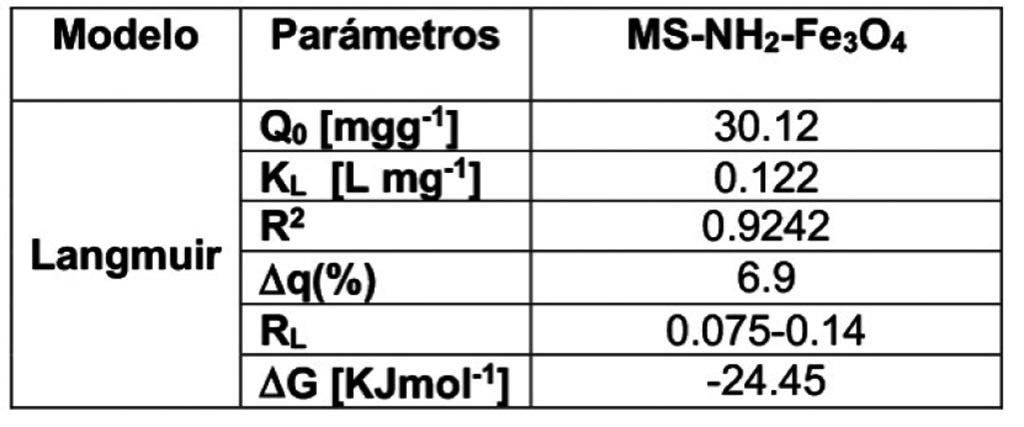
La MS-NH2-Fe3O4, mostró una remoción del 99% a concentraciones bajas de 100 y 200 ppm, disminuyendo su capacidad de remoción a concentraciones moderadas de 300 y 500 ppm, removiendo entre el 80-75 % de la plata únicamente (Figura 2). Todos los materiales mostraron un equilibrio de adsorción a los 20 minutos de contacto, en la Tabla 2, se resume los parámetros de adsorción observados de acuerdo al modelo de adsorción de Langmuir, el cual presume una adsorción en monocapa y nula interacción entre sorbato-adsorbente y sorbato-sorbato, la ecuación 1, muestra dicho modelo.
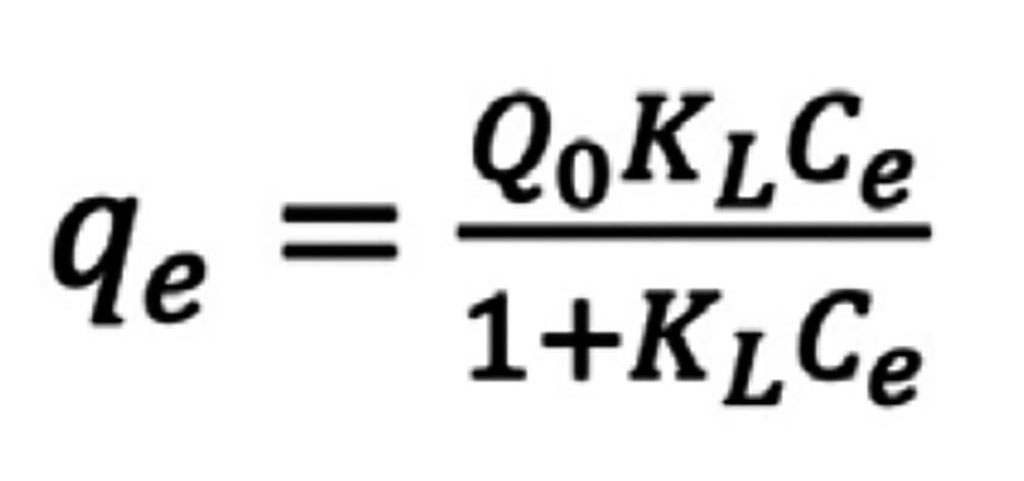
Ecuación 1
Donde: Q0 es la carga al equilibrio en mgg-1, KL la constante de Langmuir y Ce la concentración de la Ag(I) al equilibrio en mgL-1.
Un parámetro que permite identificar el tipo de adsorción en este modelo es el coeficiente de reparto (RL), que fue descrito por Webber and Chakkravorti en 1974 [24], este parámetro es función de la KL (constante de Langmuir) y la concentración inicial del sorbato y se define por la Ec. 2. Como ya se mencionó, el valor de la RL define el tipo de adsorción, de tal forma que si RL>1 la adsorción del sistema es desfavorable; si RL=1 la adsorción es favorable y lineal; valores de 0<RL<1 indican una adsorción favorable; mientras que valores de RL=0 indican una adsorción irreversible [24].
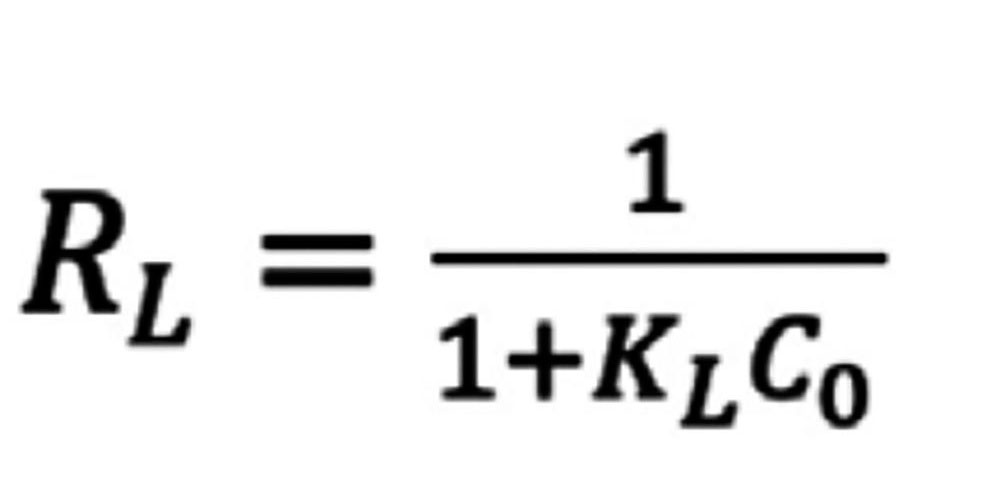
Ecuación 2
Donde: KL es constante de Langmuir y Co es la concentracoión inicial del sorbato.
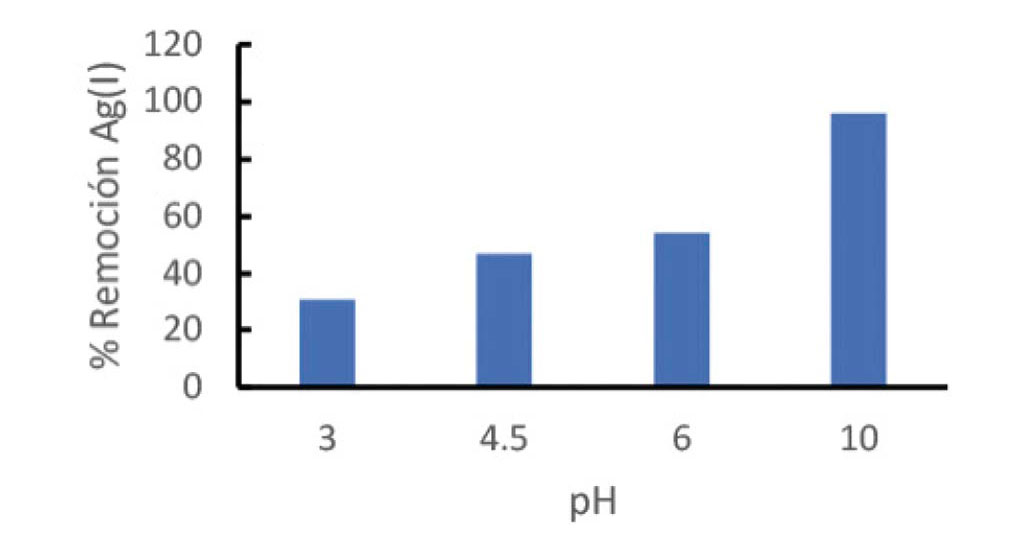
Efecto del pH en la de Adsorci.n de Ag(I)
La Figura 3, muestra el efecto del pH en la adsorción de la [Ag(H2O)2]+ con la MS-NH2-Fe3O4, se observa el aumento de la capacidad de adsorción de la Ag(I) a medida que aumenta el pH del sistema, se ha reportado un punto isoeléctrico cercano a 9.0 para sílices poliaminadas [25], mostrando estos materiales una carga superficial positiva a pH ácidos, lo que disminuye su capacidad de adsorción por las interacciones repulsivas entre la superficie positiva del material y el [Ag(H2O2)]+, dichas interacciones disminuyen con el aumento del pH, favoreciéndose la carga negativa en la superficie a pH básicos, lo que favorece el proceso de adsorción.
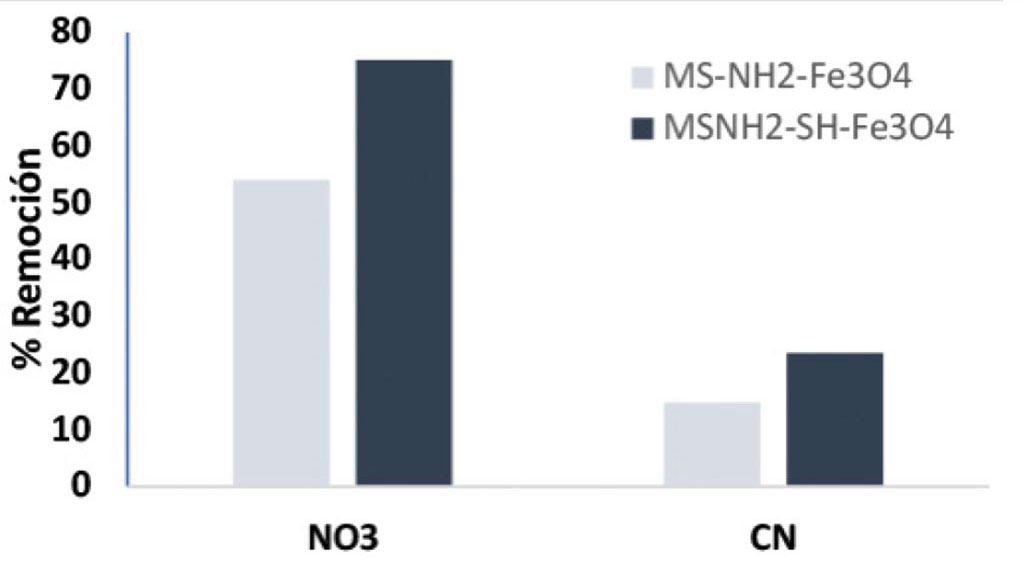
Efecto del contra-anión en la de Adsorción de Ag(I)
La Figura 4, muestra el efecto del contra-anión en la remoción de la Ag(I), se evaluó la adsorción de los complejos [Ag(H2O)2] NO3 y del [Ag(CN)2]–. Se observó una menor capacidad de remoción de los sistemas Ag-CN (remoción baja del 15%) que la observada para el nitrato de plata, donde se observó capacidades de remoción del 80%. La baja capacidad de remoción del sistema Ag-CN, puede atribuirse a la alta afinidad del cianuro por la plata, al ser este un ligando con una naturaleza blanda con alta afinidad al Ag+. Esto obliga al uso de ligandos más afines a este catión como por ejemplo grupos mercapto, tiofenos entre otros. En ese sentido se evalúo el efecto del grupo mercapto en la capacidad de remoción de la Ag en los sistemas Ag-CN, observándose una mejora en la capacidad de remoción de la plata en un 25% (Figura 4).
Conclusiones
Las sílices poliaminadas presentan cargas superficiales positivas a pH ácido, lo que desfavorece su capacidad de remoción del catión Ag(I) por repulsiones electrostáticas. Los sistemas de nitrato de plata muestran una mayor remoción con las sílices aminadas en comparación con el sistema Ag-CN, esto debido a la naturaleza poco blanda de los grupos poliamino presentes en las MS. La presencia de Ligandos de naturaleza más blanda favorece la remoción de la Ag por las interacciones Ag-L, tal como lo mostró la presencia de grupos mercapto en las MS, que favorecieron la remoción del complejo [Ag(CN)2]-.
Agradecimientos
Los autores agradecen al laboratorio nacional LICAAM, por el soporte técnico para la caracterización de la magnetita sintetizada; así como a la Universidad de Guanajuato y al IPN por el soporte económico otorgado.
Financiamiento
UG-DAIP Proyecto CII-2023
Referencias
- [1] Elham Aghaei, Richard Diaz Alorro, Ashly N. Encila, Kyoungkeun Yoo “Magnetic adsorbents for the recovery of precious metals from leach solutions and wastewater” Metals (2017) 7: 529-560.
- [2] Henrique E. Toma “Magnetic nanohydrometallurgy: a nanotechnological approach to elemental sustainability” J. Name (2013), 17: 2027-2042.
- [3] David Dupont, Jakob Luyten, Maarten Bloemen, Thierry Verbiest, Koen Binnemans “Acid-stable magnetic core-shell nanoparticles for separation of rare earths” Ind. Eng. Chem. Res. (2014) 53: 15222-15229.
- [4] N. Zndi-Atashbar, Ali A. Ensafi, Amir Hooshmand Ahoor “Magnetic Fe2CO4/rGO nanocomposite as an efficient reciclable catalyst to convert discard tire into diesel fuel and as an effective mercury adsorbent from wastewater” Journal of Cleaner Production (2018) 172: 68-80.
- [5] Ulisses Condomitti, Andre Zuin, Alceu T. Silveira, Koiti Araki, Henrique E. Toma “Magnetic nonohydrometallurgy: A promising nanotechnological approach for metalproduction and recovery using funtionalizaed supermagnetic nanoparticles” Hydrometallurgy (2012)125-126: 148-151.
- [6] Mahdieh Darroudi, Ghodsi Mohammadi Ziarani, Jahan B.Ghasemi, Shahriyar Bahar, Alireza Badiei “SBA ionic liquid as an efcient adsorbent of palladium, silver, and gold ions” Journal of the Iranian Chemical Society (2022) 19:247– 255. https://doi.org/10.1007/s13738-021-02302-z
- [7] Sotiriou K., Supanchaiyamat N., Jiang T., Janekarn I., García A.M., Budarin V.L., Macquarrie D.J., Hunt A.J. “Synthesis and application of tuneable carbon–silica composites from the microwave pyrolysis of waste paper for selective recovery of gold from acidic solutions” RSC Advances (2020) 10(42):25228 – 25238. DOI 10.1039/d0ra02279a.
- [8] Ali Beryani, Carlo Bianco, Alessandro Casasso, Rajandrea Sethi, Tiziana Tosco,” Exploring the potential of graphene oxide nanosheets for porous media decontamination from cationic dyes “ Journal of Hazardous Materials (2022) 424: 127468. https://doi.org/10.1016/j.jhazmat.2021.127468.
- [9] Abeer Beagan, Khalid Alotaibi, Manal Almakhlafi, Wafaa Algarabli, Noouf Alajmi, Manal Alanazi, Hajer Alwaalah, Fatamah Alharbi, Riyadh Alshammari, Abdullah Alswieleh, “Amine and sulfonic acid functionalized mesoporous silica as an effective adsorbent for removal of methylene blue from contaminated water” Journal of King Saud University– Science (2022) 34(2): 101762. https://doi.org/10.1016/j. jksus.2021.101762.
- [10] Shahid M., Bashir S., Habib A., Jamil A., Afzal A., Iqbal N. “Fabrication of Silica-Supported Al-Doped ZnO and Its Use in the Elimination of the Toxic Organic Ingredients from Industrial Effluents” ChemistrySelect (2021) 6(39): 10501- 10513. https://doi.org/10.1002/slct.202102291.
- [11] Jiyang Liu, Zheng Deng, Haojie Yu, Li Wang “Ferrocene-based metal-organic framework for highly efficient recovery of gold from WEEE” Chemical Engineering Journal (2021) 410: 128360. https://doi.org/10.1016/j.cej.2020.128360.
- [12] Jiling Zhao, Chen Wang, Shixing Wang, Libo Zhang, Bing Zhang, “Selective recovery of Au(III) from wastewater by a recyclable magnetic Ni0.6Fe2.4O4 nanoparticels with mercaptothiadiazole: Interaction models and adsorptionmechanisms” Journal of Cleaner Production (2019) 236: 117605. https://doi.org/10.1016/j.jclepro.2019.117605.
- [13] Syed S. “Silver recovery aqueous techniques from diverse source: hydrometallurgy in recycling” Waste Management (2016) 50: 234-256.
- [14] Bahman Abdollahi, Darioush Salari, Mahmoud Zarei, “Synthesis and characterization of magnetic Fe3O4@ SiO2-MIL-53(Fe) metal-organic framework and its application for efficient removal of arsenate from surface and groundwater” Journal of Environmental Chemical Engineering (2022) 10(2): 107144. https://doi.org/10.1016/j.jece.2022.107144.
- [15] Elham Ragheb, Mojtaba Shamsipur, Fahimeh Jalali, Farimah Mousavi, “Modified magnetic-metal organic framework as a green and efficient adsorbent for removal of heavy metals”, Journal of Environmental Chemical Engineering (2022) 10(2): 107297. https://doi.org/10.1016/j.jece.2022.107297
- [16] Zinan Zhao, Meng Wang, Xuefeng Jiang, Ruwen Lv, and Chun Mao “Fe3O4 Nanoparticles Coated with Mesoporous Shells for Pb(II) Removal from Blood”ACS Applied NanoMaterials (2022), 5(1): 249-258. DOI: 10.1021/acsanm.1c02739.
- [17] Jiafeng He, Gao Song, Xinyue Wang, Ling Zhou, Jumei Li, “Multifunctional magnetic Fe3O4/GO/Ag composite microspheres for SERS detection and catalytic degradation of methylene blue and ciprofloxacin” Journal of Alloys and Compounds (2022) 893: 162226. https://doi.org/10.1016/j.jallcom. 2021.162226.
- [18] Sarojini, S. Venkatesh Babu, N. Rajamohan, M. Rajasimman, Arivalagan Pugazhendhi, “Application of a polymer-magnetic-algae based nano-composite for the removal of methylene blue – Characterization, parametric and kinetic studies” Environmental Pollution (2022), 292( Part B): 118376. https://doi.org/10.1016/j.envpol.2021.118376.
- [19] Chunhui Luo, Tingting Zhang, Zongdi Yuan, Zheng Fu, Shuo Lv, Chengcai Huang, Baowei Hu, Yuling Zhu, Bin Zheng “Removal of hexavalent uranium [U(VI)] by magnetite in the presence of metal-reducing bacteria from rice soil” Environmental Technology & Innovation (2022) 28: 102616-102627. https://doi.org/10.1016/j.eti.2022.102616.
- [20] Jae H. Kwon, Lee D. Wilson, R. Sammynaiken “Synthesis and characterization of magnetite and activated carbon binary composites” Synthetic Metals (2014) 197: 8-17.
1 Departamento de Ingeniería en Minas, Metalurgia y Geología, Universidad de Guanajuato.
2 Unidad Profesional Interdisciplinaria de Ingeniería Campus Guanajuato, Instituto Politécnico Nacional.


















