Cinética de Lixiviación de cobre en un mineral mixto de baja ley
Por: Jorge Enrique Ruiz Hernández1, Adriana Zavala García2, Bianka R. Jiménez Tolano3
Resumen
La lixiviación de sulfuros de cobre en medio acuoso ácido y en presencia de ión Férrico (Fe+3) como principal agente oxidante es la tecnología utilizada actualmente, la cual ha arrojado resultados favorables al proceso. Sin embargo, es importante mantener un control en las variables del proceso que permitan incrementar la cinética de lixiviación y a su vez, favorezcan la extracción de Cobre por lixiviación.
Esto es posible sólo bajo apropiadas condiciones termodinámicas, los diagramas de fase (diagrama de Pourbaix) se utilizan para determinar estas condiciones y el medio de disolución que será necesario. Sin embargo, es fundamental conocer la mineralogía del mineral porque no todas las opciones de lixiviación son adecuadas para cualquier mineral y la dependencia de la concentración de los reactivos en el proceso y el pH, ya que permite obtener datos de correlación entre la desviación de estas variables con la extracción de Cobre.
El objetivo del presente trabajo es estudiar la cinética de lixiviación de cobre, en minerales mixtos con mayor preponderancia de sulfuros como Covelita, Calcocita y Calcopirita; del cual se concluye que a mayor concentración de ion Férrico y un pH constante de 1.4, la disolución de cobre se ve beneficiada, y en consecuencia, la velocidad de extracción.
Abstract
The leaching of Copper sulphides in an acidic medium and in the presence of Ferric ion (Fe+3) as the main oxidizing agent is the technology currently used, which has produced favorable results to the process. However, it is important to maintain control in the process variables that allow for an increase in the leaching kinetics and at the same time in favor the extraction of Copper by leaching.
This is possible only under appropriate thermodynamic conditions, the phase diagrams (Pourbaix diagram) are used to determine these conditions and the medium of dissolution that will be necessary. It is essential to know the mineralogy of the mineral because not all leaching options are suitable for all mineral types, and the dependence of the concentration of the reactive in the process and the pH, since it allows to obtain correlation data between the deviations of these variables with Copper extraction.
The objective of this work is to study the kinetics of Copper leaching mixed minerals with higher preponderance of sulfides, such as Covellite, Chalcocite y and Chalcopyrite; from which it is concluded that the higher concentration of Ferric ion and a constant pH, of 1.4, the Copper solution is benefited, and consequently, the speed of extraction
Introducción
En los últimos años la lixiviación de minerales de baja ley de Cobre se ha visto afectada por el agotamiento de reservas de óxidos de este metal e incremento de la presencia de sulfuros secundarios, como Calcocita (Cu2S) y Covellita (CuS) y sulfuros primarios, como Bornita (Cu5FeS4) y Calcopirita (CuFeS2) y otros minerales que alteran el proceso de disolución de Cobre.
La lixiviación de sulfuros de Cobre en medio acuoso ácido y en presencia de ión Férrico (Fe+3) como principal agente oxidante es la tecnología utilizada actualmente, la cual ha arrojado resultados favorables al proceso. Sin embargo, es importante mantener un control en las variables del proceso que permitan incrementar la cinética de lixiviación y a su vez, favorezcan la extracción de Cobre por lixiviación.
Esto es posible sólo bajo apropiadas condiciones termodinámicas, los diagramas de fase se utilizan para determinar las características del medio de disolución que será necesario. De acuerdo a la descripción del diagrama de Pourbaix para el sistema acuoso Cu-Fe-S a 25°C, la disolución de cobre se lleva a cabo a un pH menor a 5.0 y potenciales mayores a +0.2V, no obstante, la zona de estabilidad del ión Férrico requiere de altos potenciales de oxidación siendo superiores a +0.5V y un pH menor a 2.

Comprender la estabilidad termodinámica de las especies nos permite obtener un punto de partida, sin embargo, es fundamental conocer la mineralogía del mineral porque no todas las opciones de lixiviación son adecuadas para cualquier mineral, ya que existen factores adyacentes a este que pudieran ocasionar una consecuencia en la velocidad de dilución como la porosidad, la distribución del mineral, tamaño de partícula, el consumo de ácido por la ganga, impurezas, entre otros; y la dependencia de la concentración de los reactivos en el proceso y el pH, ya que permite obtener datos de correlación entre la desviación de estas variables con la extracción de Cobre, englobando datos de cinética de lixiviación, de los cuales se obtienen parámetros operativos adecuados (tamaño de partícula, altura de apilamiento, densidad de riego, entre otros).
Reacciones del proceso de lixiviación de sulfuros de cobre.
Los sulfuros de Cobre se disuelven en presencia de ión Férrico e ión Hidrógeno de acuerdo a las siguientes reacciones:
La Covelita, Calcocita y Calcopirita se disuelve en medio ácido en presencia de oxígeno:
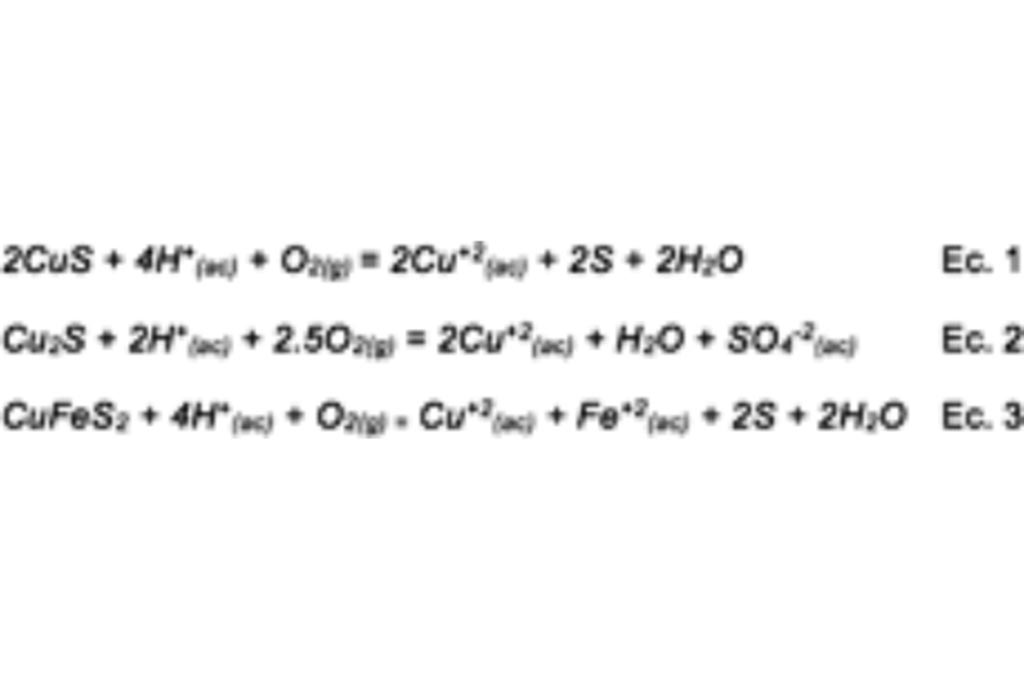
Proceso que conlleva una cinética lenta, probablemente debido a la baja solubilidad del Oxígeno.
No obstante, la Covelita, Calcocita y Calcopirita se disuelven directamente con ión Férrico, acelerando así el proceso y mitigando el impacto de la escasez de Oxígeno en la solución acuosa.
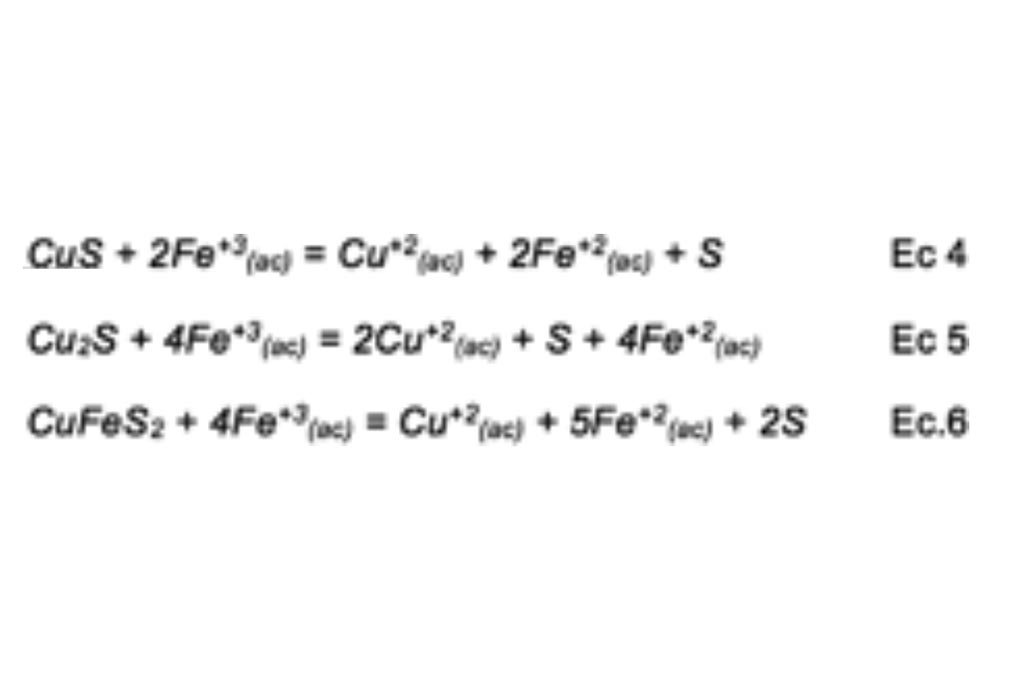
El ión Ferroso se vuelve a oxidar a Férrico cuando reacciona con oxígeno disuelto en la solución en medio ácido, siendo esta una de las gentilizas del proceso, según la siguiente ecuación.
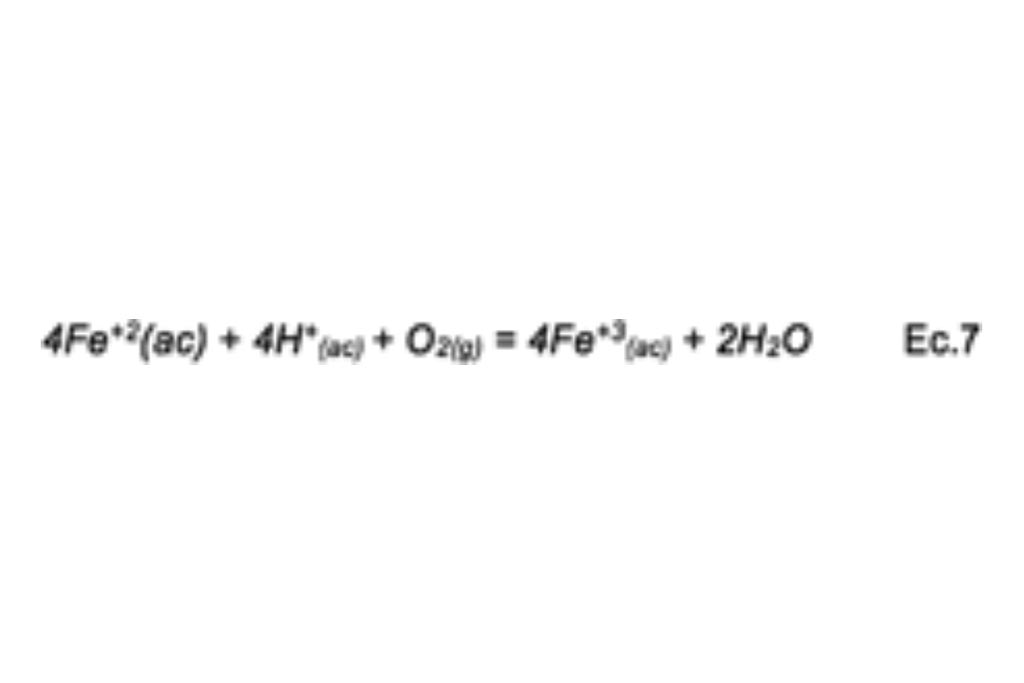
Como se observa, la lixiviación de sulfuros de Cobre es posible, aunque existe evidencia que el proceso posee una cinética lenta, aunque no se ha llegado a una teoría aceptada de las causas de dicho problema, existen deducciones que proponen que una de las principales causas se debe a la formación de una capa de Azufre elemental y la precipitación de Hierro en forma de compuestos complejos (Jarositas).
Metodología experimental
Se realizan 5 pruebas a las cuales se le hicieron modificaciones en la concentración de ión férrico y pH; en cada una se utiliza pulpa al 10% en peso a una temperatura de 25°C. Cada prueba fue desarrollada mediante lixiviación por agitación, esto con la finalidad de tener un mayor control del proceso, volumen y temperatura constante y obtener la máxima extracción de cobre posible.
Soluciones de lixiviación
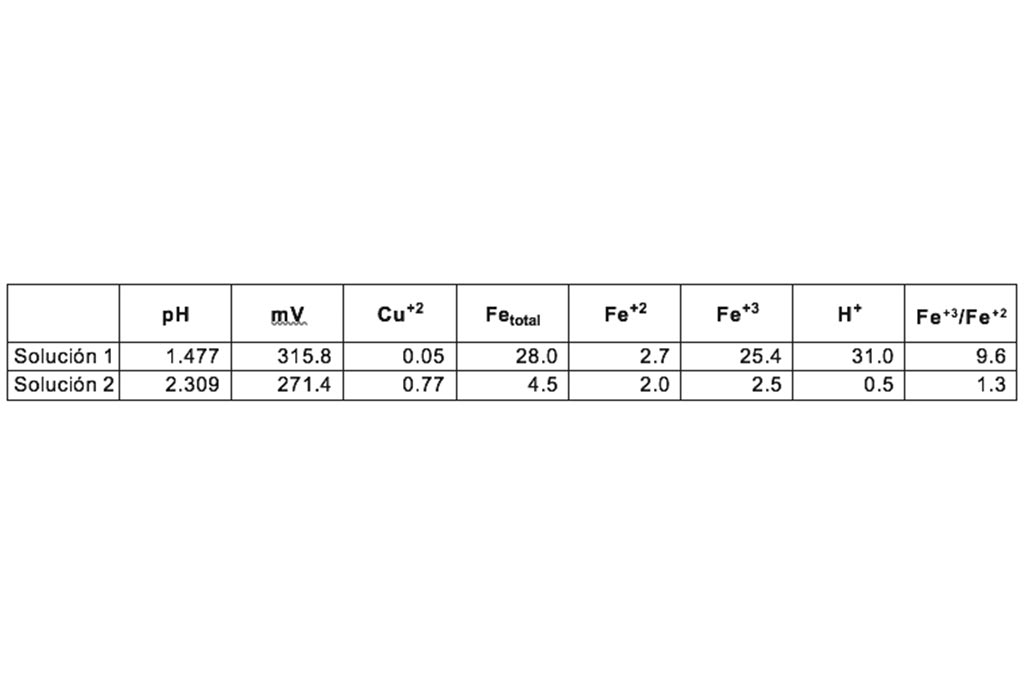
Se utilizan dos soluciones, la primera con alta concentración de ion férrico y bajo pH, la segunda con baja concentración de ion férrico y un pH mayor.
Análisis mineralógico y químico
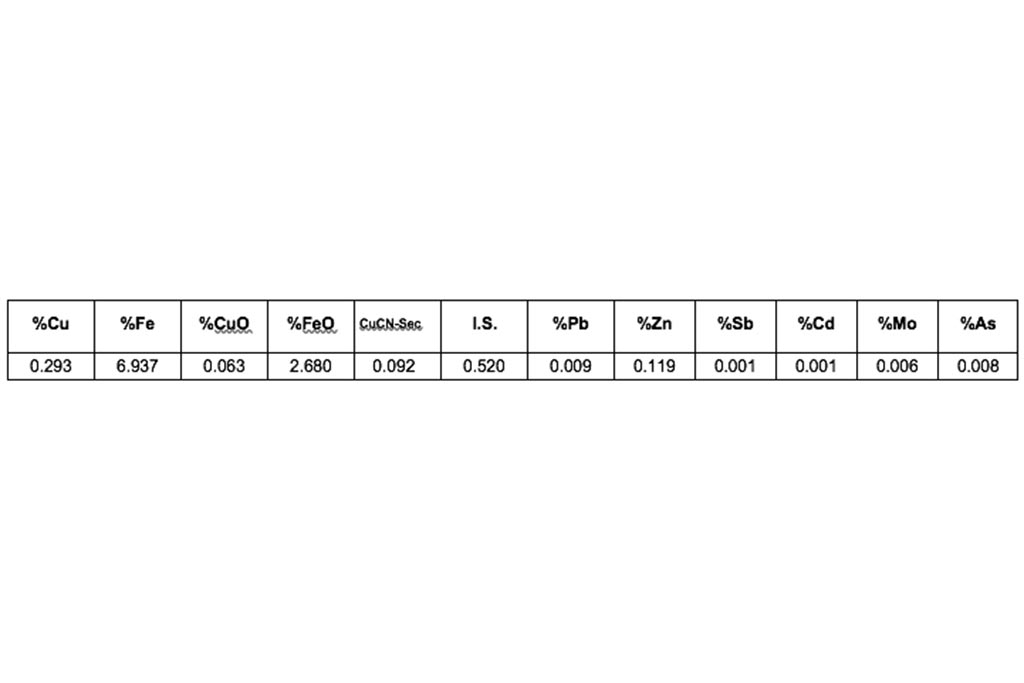
Análisis mineralógico: Volcánica Henrieta color verde oscuro de textura afanítica, presenta minerales de Magnetita y Biotita muy fina, óxidos de Hematita, diseminado muy fino de Calcita, moderada-escasa Calcopirita y Pirita moderada, vetillas de Hematita. La roca presenta óxidos de Jarosita y una alteración fílica Si 60%-Ser 40%.
El análisis químico de la composición del mineral se describe en la Tabla 2, en la que se muestra una alta ocurrencia de sulfuros de cobre.
Resultados y discusiones
Prueba 1, mineral con solución 1
La prueba se realizó sin ajuste de condiciones, con el objetivo de definir la posibilidad del proceso y la máxima extracción de cobre.
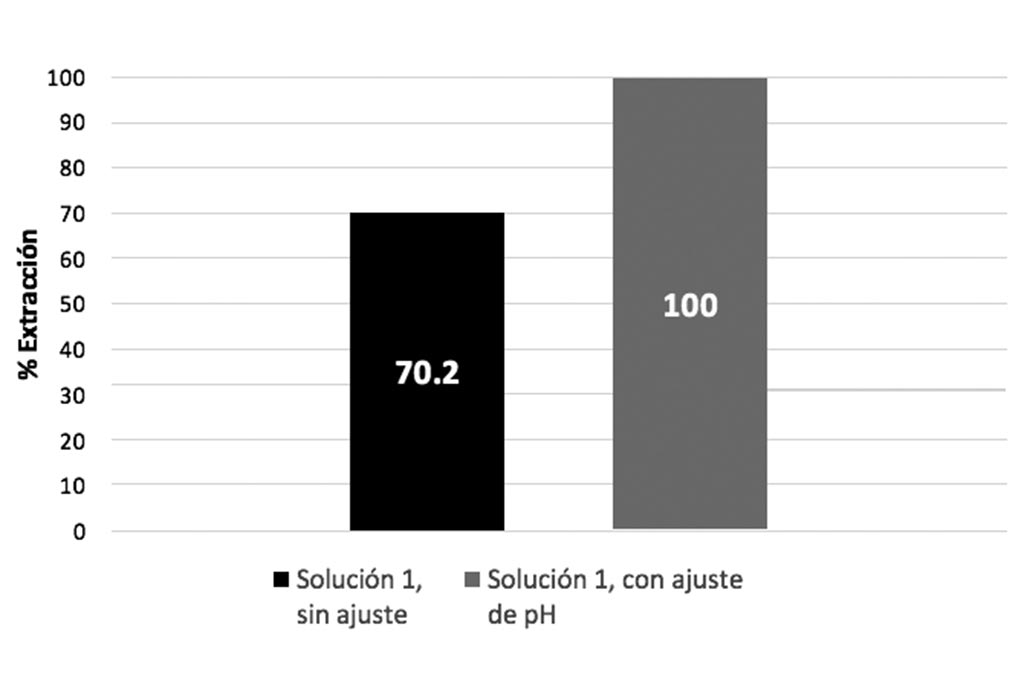
Después de un lapso de 86 horas la disolución de cobre se detiene obteniéndose un 70.2% de extracción. Los resultados se muestran en la Tabla 3.
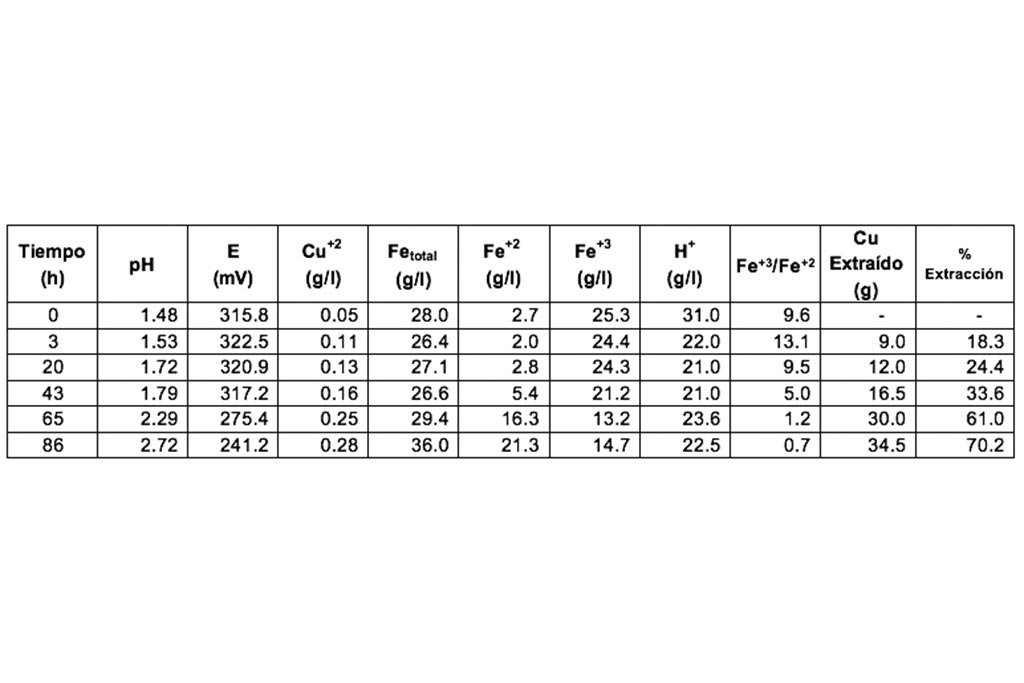
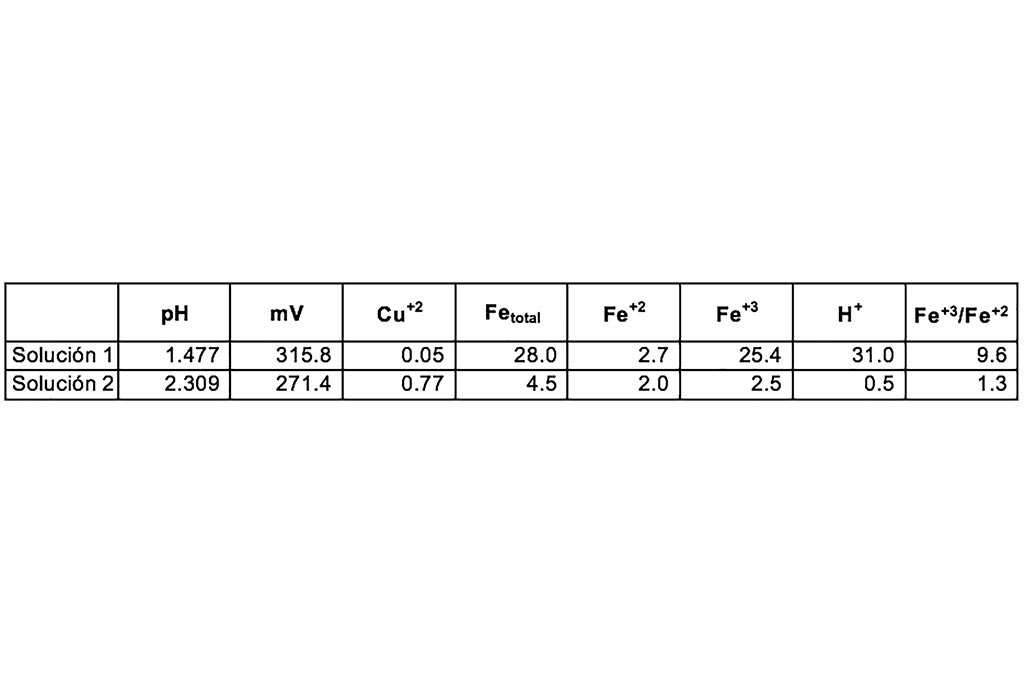
Se observa un incremento en el pH y reducción del ion férrico a ion ferroso, por lo que se puede deducir que existe un consumo de ácido y una reducción de ion férrico durante el proceso de lixiviación.
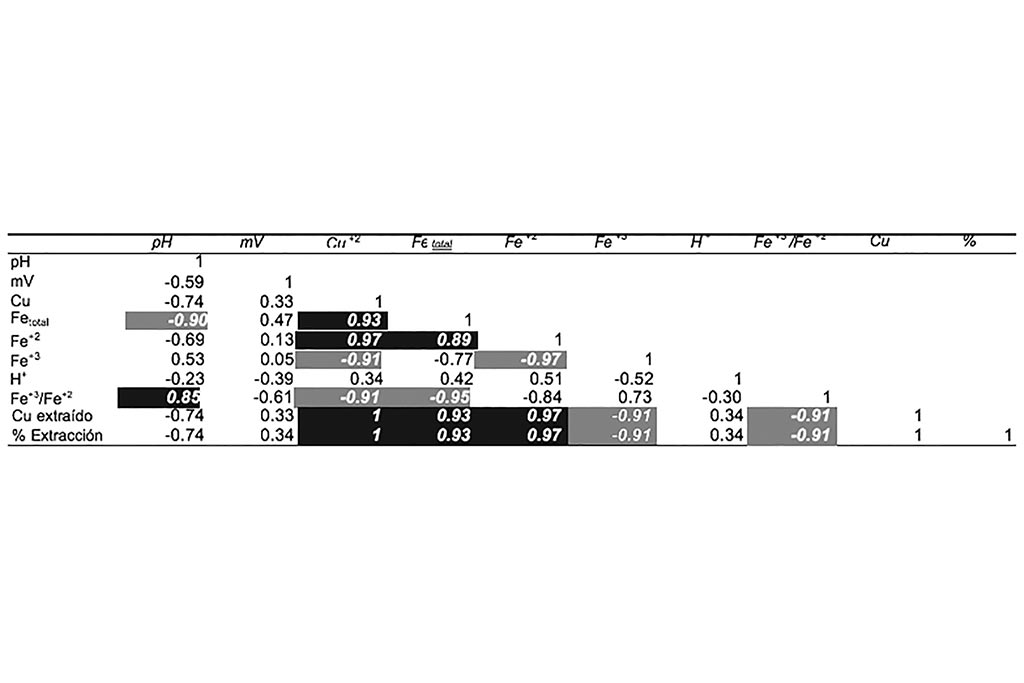
La Tabla 4 muestra la relación de las variables del proceso sobre la extracción de cobre (concentración de Cu+2). Donde el pH, potencial y concentración de Férrico, son las de mayor interés; siendo el pH la variable de mayor impacto, con una correlación igual a 0.96.

En las siguientes gráficas se representa el comportamiento de las variables que intervienen en la extracción de Cobre en función del tiempo.
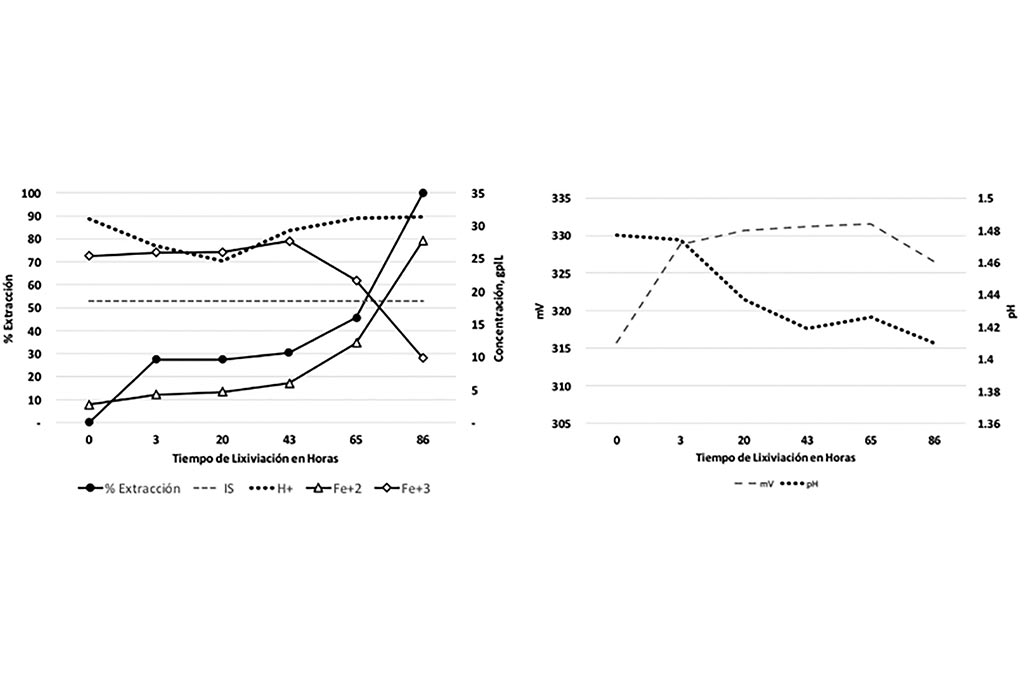
En la Gráfica 1 se muestra la línea del índice de solubilidad que indica la máxima cantidad de cobre soluble esperada en la lixiviación de esta muestra, también se ilustra el porciento de extracción de Cobre, donde podemos observar que la extracción fue mayor al esperado (Total de Cobre Soluble).
En la Gráfica 2 se observa el comportamiento pH – potencial llevado a cabo en la reacción, a medida que el pH aumenta el potencial disminuye.
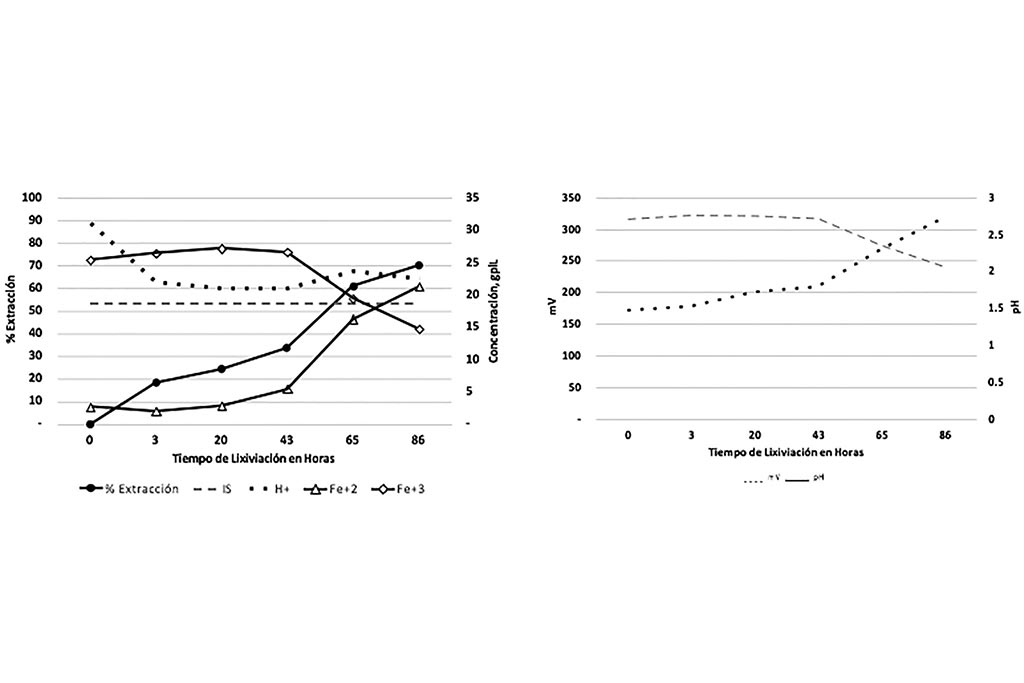
Gráfica 1 y 2. Variables que Intervienen en la Lixiviación con Respecto el Tiempo, Prueba 1
Lo anterior comprueba que las variables predominantes en el proceso de lixiviación de cobre son el pH y el ión férrico.
Prueba 2, mineral con solución 1, con ajuste de ph 1.4 +/- 0.04
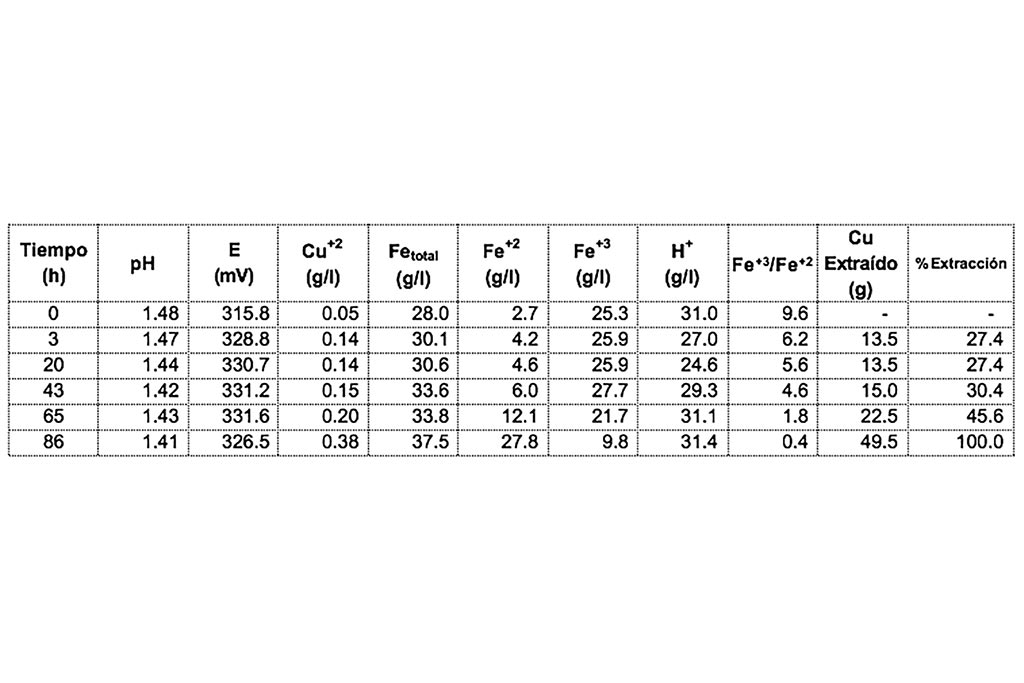
En la siguiente prueba se controló el pH, manteniendo un ambiente ácido durante el tiempo de la prueba. Después de un lapso de 86 horas se obtiene 100% de extracción de cobre como se muestra a continuación.
Se muestra un incremento en la reducción de ión férrico a ferroso, y una baja correlación entre el pH y la disolución de cobre, como se puede reforzar en la Tabla 6.
La correlación nos indica que la lixiviación en medio ácido controlado favorece la lixiviación de las diferentes especies de minerales de cobre por la capacidad oxidante del ion férrico.
Gráficas 3 y 4. Variables que intervienen en la lixiviación con respecto el tiempo, Prueba 2
En la Tabla podemos observar que la concentración de Hierro está relacionada con la extracción de Cobre, a medida que la concentración de Hierro aumenta también lo hace la extracción de Cobre, al mismo tiempo se observa que el ambiente ácido en la solución favorece a la lixiviación. La relación pH-potencial, nos indica que, a mayor potencial, menor pH, por lo tanto, mayor extracción.
Prueba 3, mineral con solución 2
La prueba se realizó a temperatura constante, sin ajuste de condiciones, utilizando valores de pH superiores a los recomendados y a bajas concentraciones de ion Férrico, con la finalidad de definir la posibilidad del proceso y la máxima extracción de cobre.
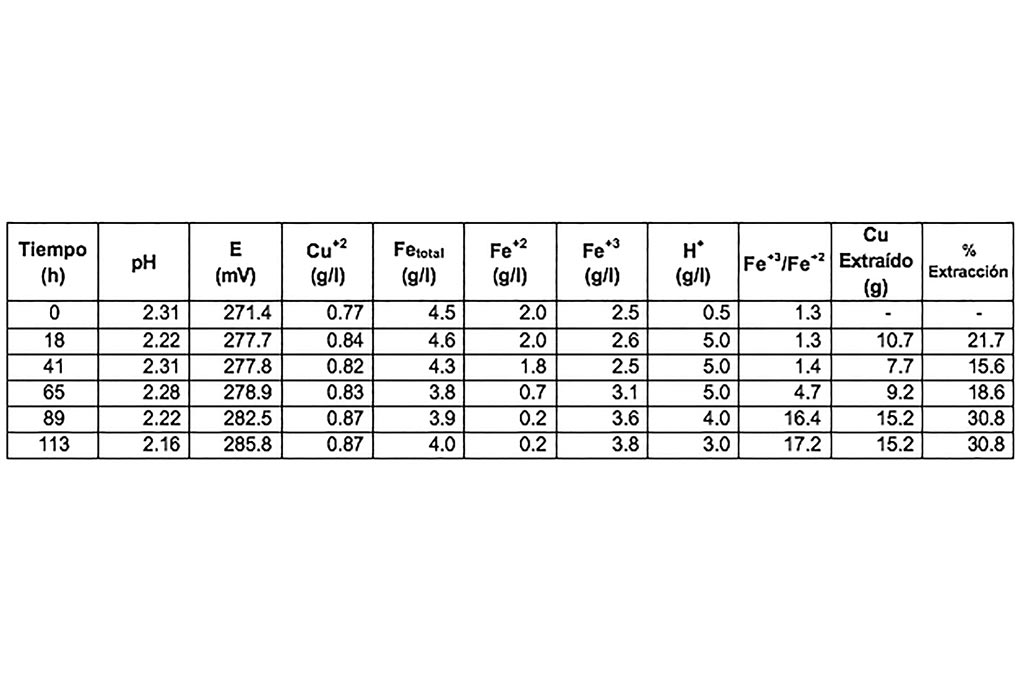
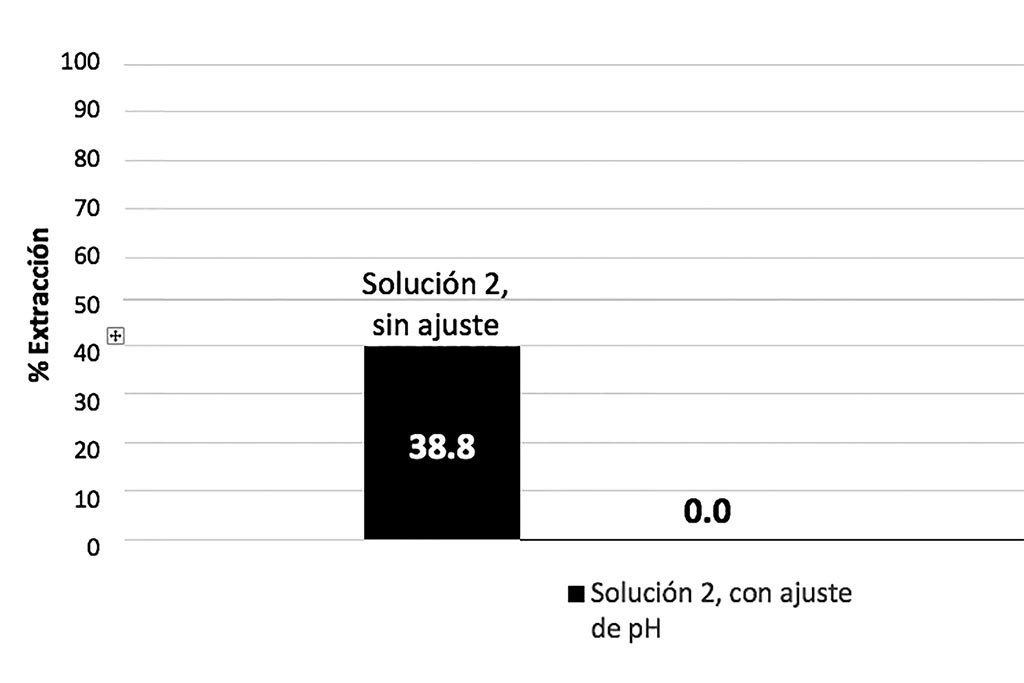
No se aprecian variaciones en el pH, reducción del ion férrico o cambios significativos durante el proceso, aun cuando se incrementó el tiempo de lixiviación la máxima extracción de cobre fue de 30.8%.
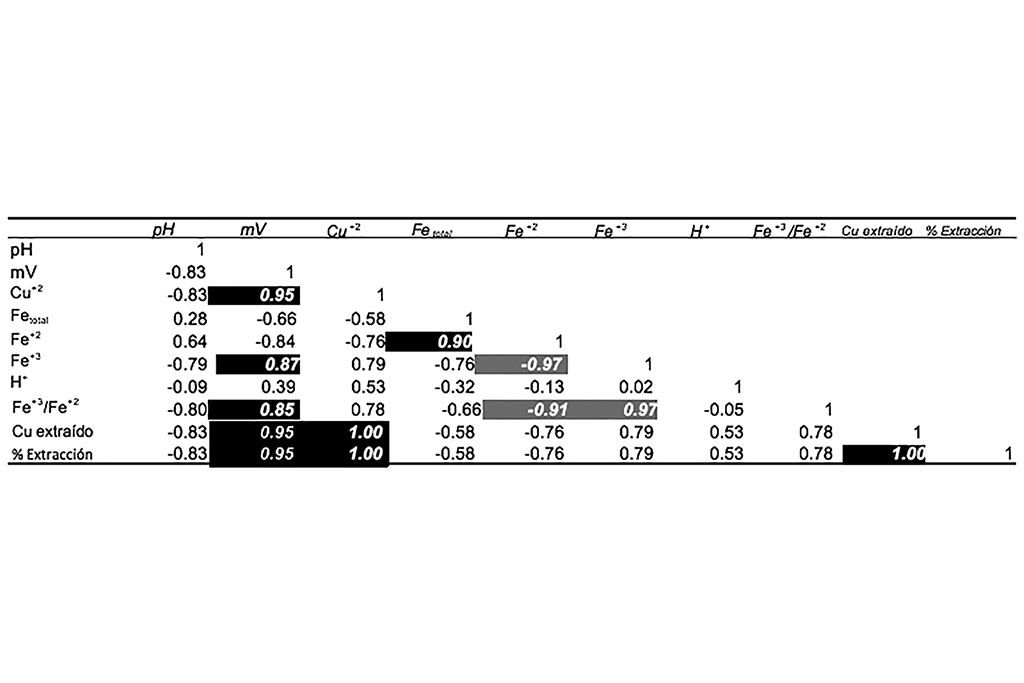
La correlación nos indica que ninguna de las condiciones de las variables favorece la extracción de cobre, mostrando que a valores de pH superiores a 2 no se aportan las condiciones para una adecuada disolución de este metal.
Las Gráficas que siguen ilustran las principales variables que intervienen en la lixiviación de Cobre, donde podemos observar que hubo extracción de los óxidos y una fracción de los sulfuros secundarios presentes en el mineral.
Prueba 4, mineral con solución 2, con ajuste de ph 1.4 +/- 0.04
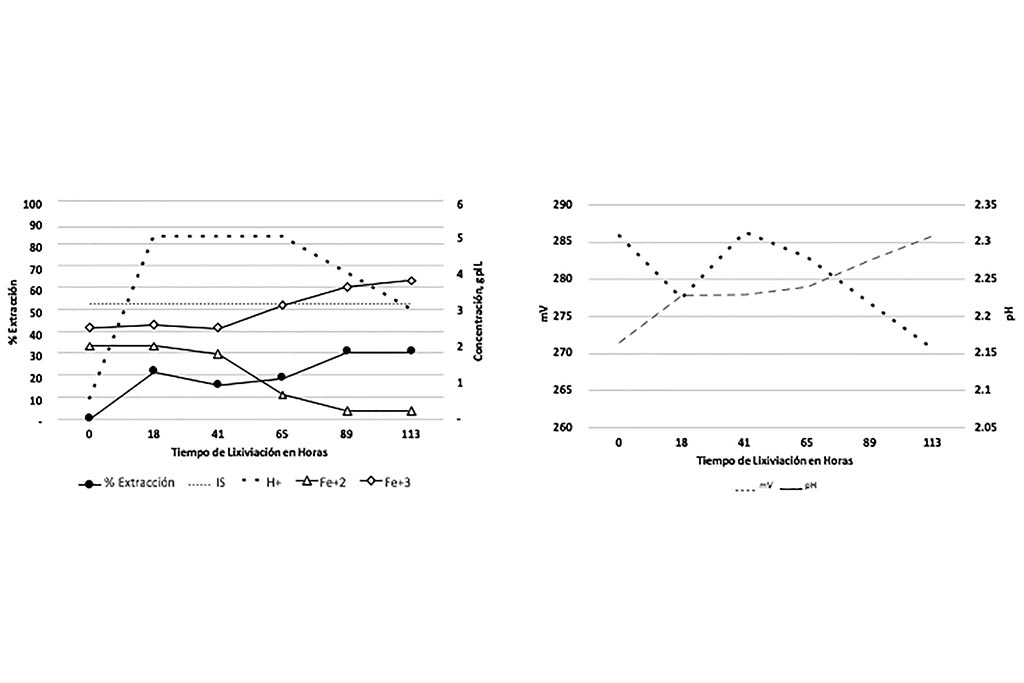
En la siguiente prueba se controló el pH, manteniendo un ambiente ácido durante el tiempo de la prueba y una concentración de férrico considerablemente baja.
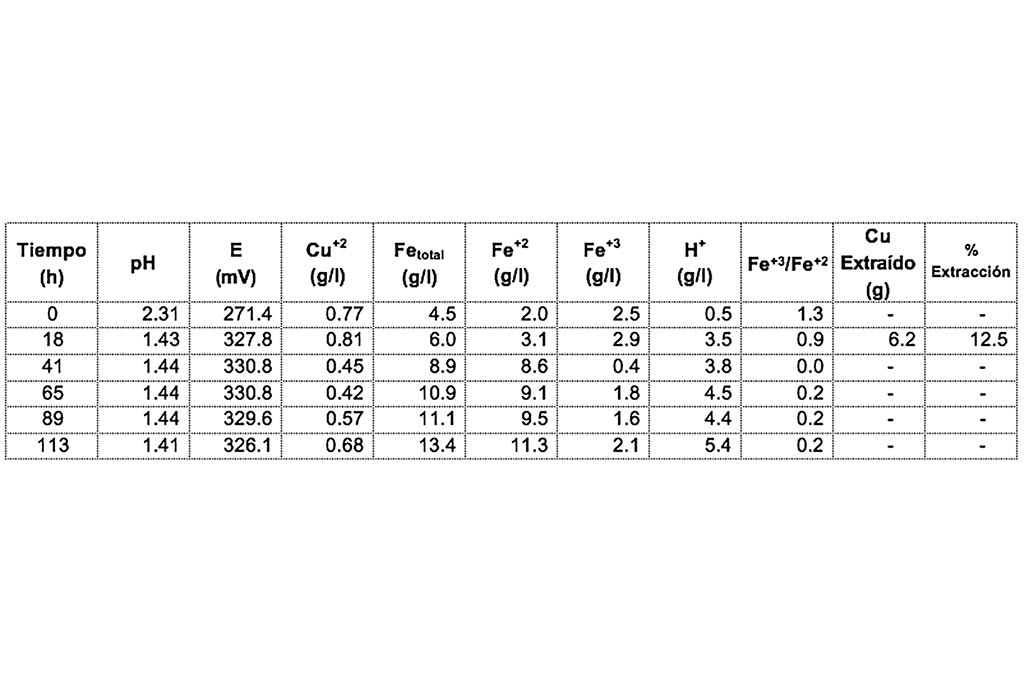
Durante el desarrollo de la prueba de lixiviación se pudo observar una considerable precipitación de Cobre que pudiera haber sido ocasionado por la presencia de Hierro metálico en el mineral. Además, se observa un incremento en la extracción de Hierro en su forma ferrosa.
Entre las variables presentes en el proceso se representa a continuación

La correlación nos indica que ninguna de las condiciones de las variables favorece la extracción de Cu, aún con el control de pH.
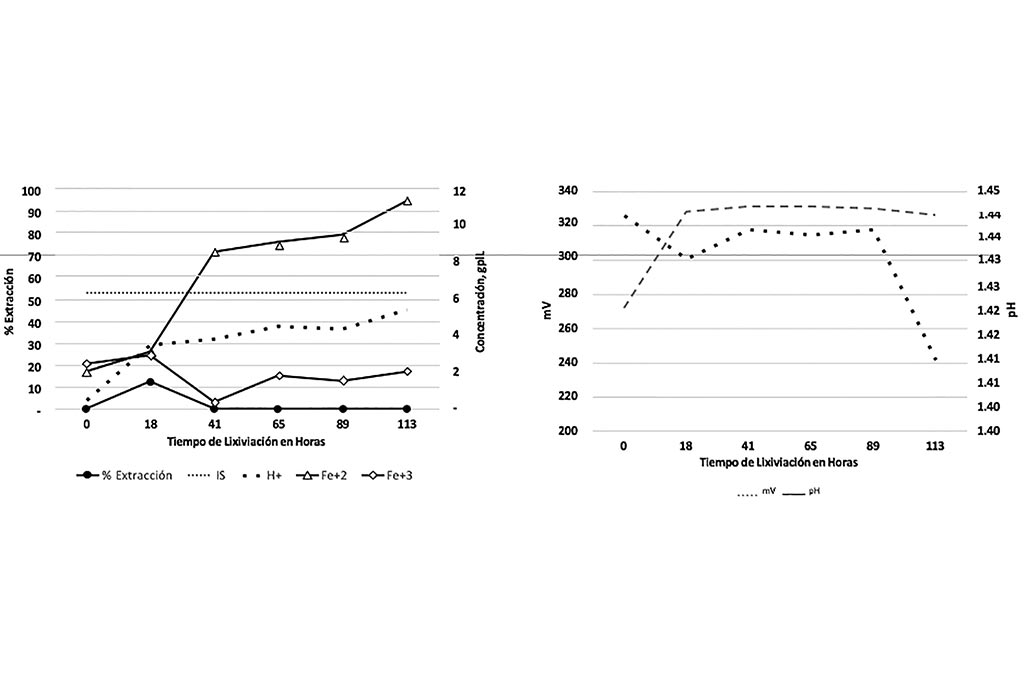
Gráfica 7 y 8. Variables que Intervienen en la Lixiviación con Respecto el Tiempo, Prueba 4
En esta aprueba no hubo extracción de Cobre, ya que no tenía las condiciones para que se llevara a cabo la lixiviación de los sulfuros de Cobre por falta del ión Férrico.
Prueba 5, aumento de ph en la solución
Esta prueba se realizó para advertir el efecto del incremento de pH en el proceso de lixiviación y comprobar así las condiciones de pH ideales de lixiviación.
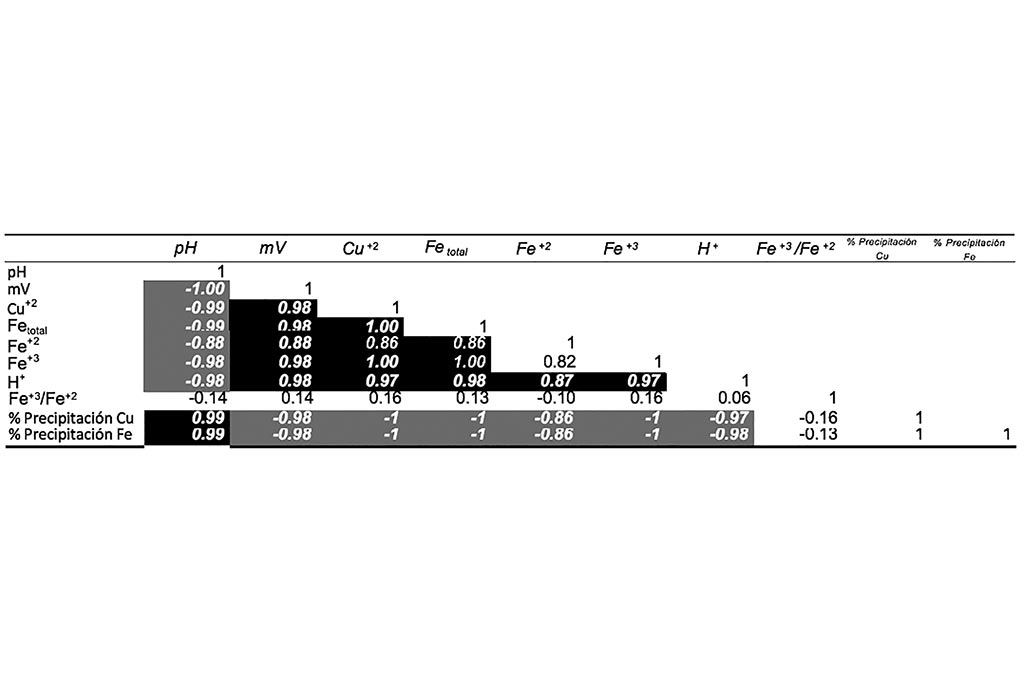
La correlación demuestra que el aumento de pH afecta directamente a todas las variables de lixiviación.
Las gráficas anteriores comprueban que a medida que el pH aumenta la concentración de agentes oxidantes disminuye, generando una co-precipitación de Hierro y Cobre. El Hierro se precipita en todas sus formas (Férrico y Ferrosa), el cambio de potencial genera condiciones reductoras.
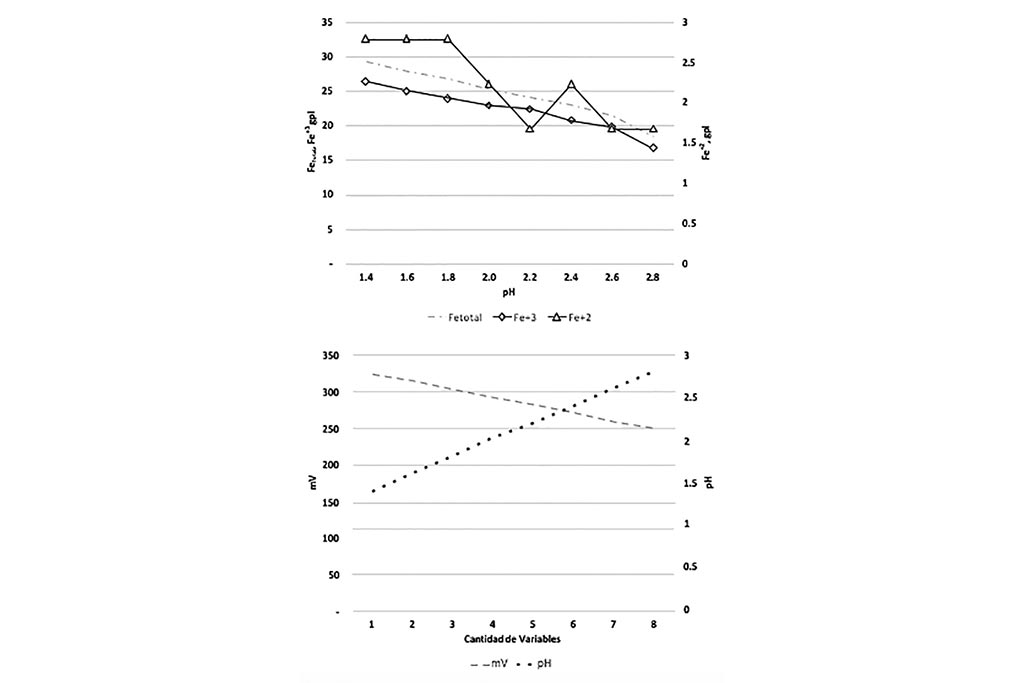
lixiviación con respecto el Ph, Prueba 5
Conclusiones
Prueba 1 y 2.- Mineral con solución 1, sin ajuste; mineral con solución 1, con ajuste de ph 1.4 +/- 0.04.
La Gráfica 11 ilustra la comparación de extracción de cobre entre las pruebas que utilizan la solución uno. Podemos observar que la prueba con control de pH, donde la acidez se controló, tuvo mayor extracción, ya que el ambiente ácido genera condiciones favorables para una mejor lixiviación de cobre
Prueba 3 y 4.- Mineral con solución 2, sin ajuste; mineral con solución 2, con ajuste de ph 1.4 +/- 0.04.
La solución con baja concentración de ión Férrico, alto pH y baja concentración de acidez inhibe la lixiviación y en cierto tiempo produce la precipitación de los valores de Cobre y otros elementos.
La diferencia de las características de las soluciones utilizadas en las pruebas se manifiesta en los resultados obtenidos.
Solución 1: Los mejores resultados se obtuvieron con esta solución, que contiene alta concentración de ión Férrico, un pH de solución lixiviante igual a 1.4 que permitiera manejar una variación de ± 0.2 de pH como máximo, y una concentración de entre 25 y 30 gramos por litro de ácido sulfúrico.
Solución 2: Esta solución contiene una baja concentración de ión Férrico, alto pH, baja concentración de acidez inhibe la lixiviación y en cierto tiempo produce la precipitación de los valores de Cobre y otros elementos.
Prueba 5.- Aumento de ph en la solución
La gráfica que sigue indica que a medida que el pH se propicia la co-precipitación de Cobre e Hierro.
Por lo que esta prueba nos ayuda a comprobar que las condiciones ideales para la lixiviación es tener o generar un ambiente ácido, con pH entre 1.2 y 1.4.
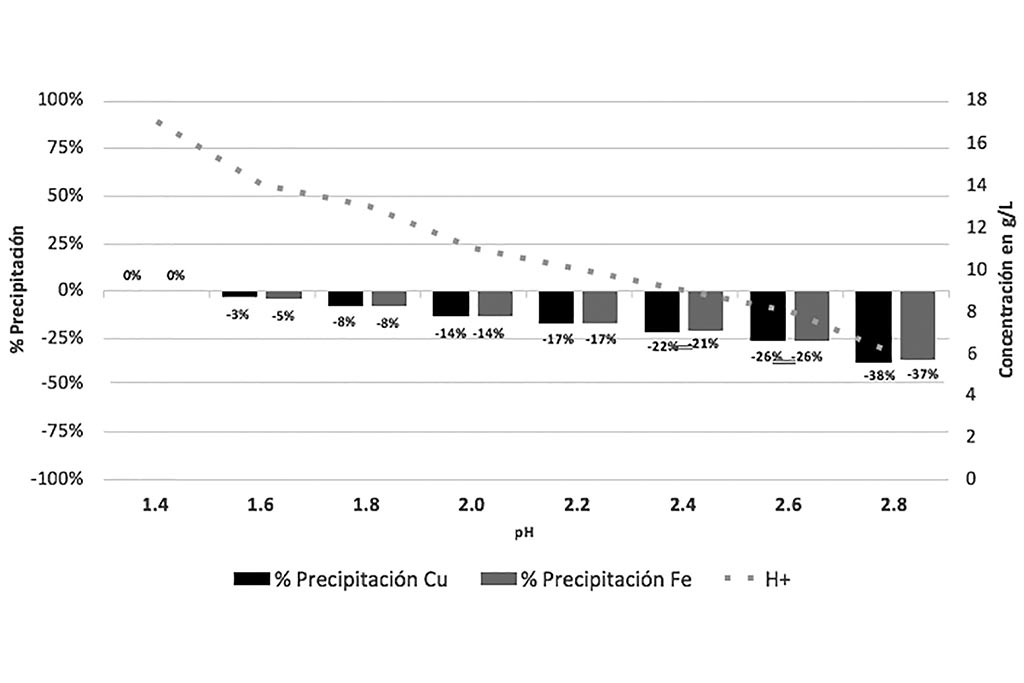
Se concluye que el proceso de lixiviación Férrica, en medio ácido, permite disolver los sulfuros, pero con la necesidad de re-oxidar el ión Ferroso formado para permitir a este agente oxidante realizar su reacción de lixiviación. Aunque no fue alcance de este estudio se recomienda favorecer el crecimiento bacterial bio-oxidantes para catalizar las reacciones de disolución de sulfuros de Cobre.
Referencias Bibliográficas
- Free, M. (2013). Hydrometallurgy : fundamentals and applications. DOI: 978-1-118-23077-0. p.85-87.
- Córdoba, E.M. (2008). Leaching of chalcopyrite with ferric ion. Part I: General aspects, Hydrometallurgy. DOI:10.1016/j.hydromet.2008.04.015
- 1 Superintendente de Desarrollo Tecnológico y Laboratorio ESDEIII, Buenavista del Cobre, Cananea Sonora.
- 2 Analista Químico en Planta Generadora, La Caridad, Nacozari, Sonora.
- 3 Supervisor de Calidad y Mejora Continua, Buenavista del Cobre, Cananea, Sonora.
Email: jorge.ruiz@mm.gmexico.com, azavalag@gminfra.mx, bianka.jimenez@mm.gmexico.com


















